华东医药利拉鲁肽报产 GLP-1减肥药研发大战正当时
继仁会生物的贝那鲁肽之后,7月13日,华东医药的利拉鲁肽肥胖适应症也申报了上市。如进展顺利,这两款GLP-1减肥药均有望明年获批,从而给国内肥胖患者带来福音。当前,GLP-1已成为减肥市场上最热门的靶点,随着技术的进步和研发的推进,效果更好、使用更方便的GLP-1减肥药物也有望不久后出现。
人民金融·创新药数据库监测显示,在7月8日至7月14日的新发布周期内,恒瑞医药1类新药注射液的上市申请获CDE受理。另外,来自海正药业、甘李药业、君实生物等的7个创新药项目首次获批临床,恒润达生生物、荃信生物等的1类新药步入了二期临床。
受这些因素推动,新发布周期内,“人民金融·创新药指数”上涨了0.48%,最新报2764.97 点。
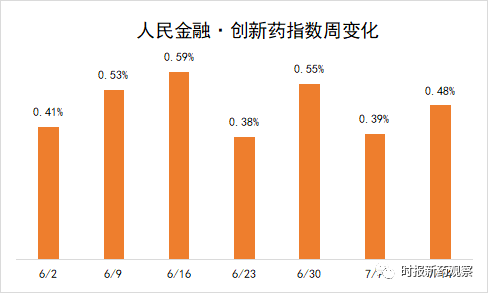
首个利拉鲁肽减肥药申报上市
7月13日晚,华东医药公告,其利拉鲁肽注射液用于肥胖或超重适应症的上市许可申请获得受理。
这是继仁会生物的贝那鲁肽后,国内第二款申报上市的GLP-1减肥药,也是国内首个递交减重适应症注册申请的利拉鲁肽。如进展顺利,未来一年左右,中国将迎来首个获批的减肥新药。
利拉鲁肽是一种人胰高血糖素样肽-1(GLP-1)受体激动剂,与人GLP-1具有97%的序列同源性,临床主要用于改善成年人2型糖尿病的血糖控制,在国外也被获批用于肥胖或体重超重患者的治疗。
2014年12月,诺和诺德在全球首先开发出利拉鲁肽减肥药。根据诺和诺德的Ⅲ期临床试验数据显示,在坚持使用56周之后,约62%的肥胖患者体重下降了5%,34%的患者体重下降幅度达到10%。
利拉鲁肽减肥适应症的开拓,为诺和诺德带来了巨大的商业回报。据统计,2020年利拉鲁肽()销售额已达8.6亿美元,占全球减重药物销售额的五成以上。
而随着时间的推移和技术的进步,性能更佳、安全性更好的减重药物也在逐渐步入市场。
2021年6月,诺和诺德的第二代GLP-1激动剂“司美格鲁肽”获FDA批准用于治疗肥胖症。临床数据显示,司美格鲁肽的减肥作用是的两倍,接受该药治疗的肥胖症患者在68周内平均体重减轻了15%-18%。优异的临床数据,使其一举成为减肥药物明星。不久前,诺和诺德将该减肥药2025年的销售额目标上调至250亿丹麦克朗(合37亿美元)。
2022年4月29日,礼来宣布其双靶点GLP-1药物在治疗肥胖症或超重群体的首个注册性全球临床试验中达到共同主要终点。接受最高剂量治疗的亚组平均体重降低22.5%(约24公斤),并且63%的受试者体重降低至少20%。这是在3期临床试验中首个将体重平均降低超过20%的在研药物,减重效果堪称强悍。
目前,我国成年居民超重肥胖率超过50%,是全球超重肥胖率最高的国家。根据去年底CDE发布的《体重控制药物临床试验技术指导原则》,我国目前仅有奥利司他胶囊一种药物获批用于肥胖或体重超重患者的治疗,合规、安全及有效的体重控制药物存在巨大未被满足的临床需求。
而以利拉鲁肽为代表的GLP-1类药物在减重方面呈现出显著的治疗效果,兼具减肥、降糖和心血管获益的功效,成为国内诸多药企研发角逐的对象。
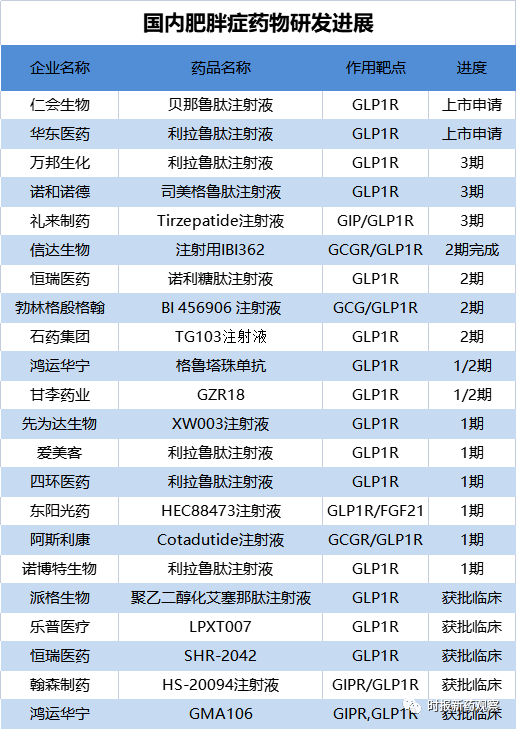
据我们统计,目前国内已有仁会生物、华东医药、信达生物等超过20家企业在布局GLP-1受体激动剂用于体重控制的适应症研发。
从研发进度来看,仁会生物的GLP-1创新药贝那鲁肽已于今年3月份报产,有望成为首个国产减重创新药。华东医药紧随其后,是国内第二家提交GLP-1减肥药上市申请的企业,也是国内首家申报利拉鲁肽肥胖适应症的企业。值得一提的事,华东医药也是国内最早提交利拉鲁肽生物类似药上市申请的企业,于2021年9月获CDE受理,有望在今年年内获批。
此外,诺和诺德的司美格鲁肽和礼来的两款进口重磅减肥药,以及万邦生化的利拉鲁肽类似药也在国内开展三期临床,这三个品种有望在近一两年内递交上市申请。
从作用靶点看,当前国内处于临床阶段的GLP-1药物多为单靶点,而针对GLP-1R、GIPR、GCGR 等靶点的双重/三重激动剂在临床上表现出了赶超前代药物的突出疗效,正逐渐成为开发重点。国内处于临床阶段的品种中,信达生物的、东阳光药的、翰森制药的HS-20094等为双靶点药物,华东医药的为三靶点激动剂。
上个月,信达生物就披露了其GLP-1/GCGR双靶点激动剂()的研发进展。在中国的肥胖症二期临床研究显示,每周一次皮下注射给药,持续给药24周,与安慰剂对比,半年治疗可以带来12.6%体重降幅。这样的数据可媲美目前世界上最前沿的在研减重药物,中信建投此前表示,减重数据出色,耐受性好,预计该产品有望在2024财年第四季度正式上市销售,预计在中国的峰值销售可达30亿元以上规模。
同时,开发依从性更好的长效制剂也成为趋势。在研肥胖症药物中,诺和诺德、礼来、信达生物、勃林格殷格翰、先为达生物等的候选药有望实现一周一次的用药频次,相比仁会生物的贝那鲁肽一天需注射三次,华东医药、万邦生化等的利拉鲁肽需一天注射一次,竞争力更强。
恒瑞医药又一款1类新药报产
近日,恒瑞医药1类新药注射液申报上市获CDE受理,拟定适应症为治疗腹部手术后中重度疼痛。据介绍,该药物为靶向μ阿片受体(MOR)的镇痛小分子药物,相比传统MOR激动剂,可以在产生中枢镇痛作用的同时,降低常见的胃肠道不良反应发生率。
根据恒瑞医药的公告,目前,国外已有同类产品公司开发的于2020年在美国获批上市销售,国内尚无同类产品上市。注射液相关项目累计已投入研发费用约1.12亿元。
截至目前,恒瑞医药共有12款创新药获批上市、5款创新药在NDA阶段、12款不同领域创新药在3期临床阶段,已成为当前国内获批创新药最多、储备管线最丰富的医药企业。持续加码创新后,恒瑞医药已经进入创新药收获阶段,从其后期研发管线来看,未来公司可望每年实现2款创新药获批上市。
7个创新药项目首次获批临床
在新发布周期内,来自海正药业、甘李药业、君实生物等的7个创新药项目获批临床,包括4个生物药、3个化药,我们将其纳入了“人民金融·创新药指数”。目前,“人民金融·创新药指数”的成分样本共有1469个。
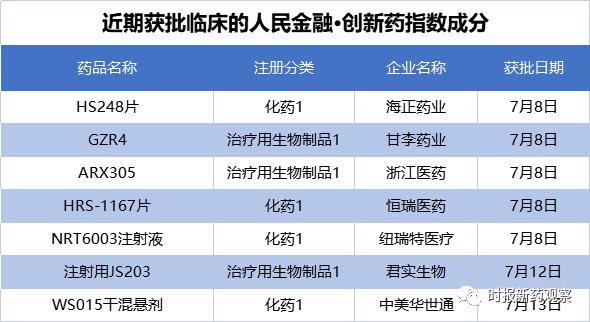
其中,海正药业的HS248片是一种高选择性的PI3Kγ抑制剂,于7月8日获临床试验默示许可,适应症为晚期实体瘤。根据海正药业的公告,HS248可以克服免疫检查点抑制剂的耐药性,HS248与PD-1等免疫检查点抑制剂进行联用,有望为PD-1抑制剂耐药性患者带来更多获益,目前尚无同类药物上市。
同日,甘李药业的GZR4获批临床,适应症为糖尿病。据介绍,GZR4是中国首款由本土企业自主研发的第四代超长效胰岛素周制剂,预计通过皮下注射每周给药一次,实现一周基础血糖的平稳控制。目前,甘李药业已成功上市多款第二、三代胰岛素产品,此次第四代胰岛素GZR4临床获批,有望进一步丰富和拓展公司的产品管线。
君实生物此次取得临床批件的JS203为一款重组人源化抗CD20和CD3双特异性抗体,主要用于复发难治B细胞非霍奇金淋巴瘤的治疗。
今年6月,罗氏的在欧洲获批,成为全球首款获批上市的CD3/CD20双抗,同时也是全球第6款获批上市的双抗药物。由于CD20/CD3在血液瘤中表现出的潜力,该双抗靶点组合成为不少创新药企角逐的方向,在JS203之前,国内已有嘉和生物的GB261、爱思迈生物的EX103、天诺健成的CM355、正大天晴的等多个同靶点双抗步入临床阶段。
临床进展方面,近日香雪制药的正式开启了II期临床研究,这是国内首个步入II期临床阶段的TCR-T细胞治疗产品。此外,中国药物临床试验登记与信息公示平台显示,近日恒润达生生物的BCMA CAR-T产品、荃信生物的IL-4Rα单抗注射液也推进至II期临床。
猜你喜欢
相关文章
减肥光靠吃药,真的靠谱吗?5种流行的“减肥药”,为你一一盘点
本文为李药师为科学辟谣平台撰写的专栏文章,分享过来与大家共享——三月不减肥,四月徒伤悲;四月不减肥,五月徒伤悲……马上到了露肉的季节,不少人都...
打一针瘦10斤的网红“减肥神药”竟是降糖药!减肥用真的安全吗?
最近“地下减肥市场”疯传一种减肥药,并且已经成为减肥者的“地下宠儿”,这种药就是司美格鲁肽,一种GLP-1类降糖药。这种药对于减肥到底多有用?看...

减肥药排行榜第一名(减肥中成药)
减肥药排行榜第一名具有减肥效果的中成药有湿消丸(七消丸)、轻身消胖丸、降脂减肥片、排毒清脂胶囊、防风通圣丸、减肥通圣片等,需要注意使用时...

国家认可唯一非处方减肥药药效几何打开电商网站搜索
吃药减肥靠谱吗 【聊健康】 7月16日,国家卫健委举行新闻发布会,健康中国行动推进委员会专家咨询委员会委...
最常见的减肥药排行榜:第一名瘦酷药
减肥药根据其减肥原理, 可分三类: 一类是影响脂肪吸收的药物,控制体重的进一步增加,但是对减重作用不明显。...
